O fenômeno de oxidorredução é uma conseqüência das ligações químicas. Um fato importante em uma ligação química é o comportamento dos elétrons.
Os dois átomos de uma ligação disputam o par eletrônico, e a intensidade da força dos átomos na disputa pode ser diferente. Desse modo, o par eletrônico é deslocado na direção do átomo que exerce mais força. Isso provoca o aparecimento de resíduos de cargas nos átomos da ligação, e esses são denominados pólos. Assim, atribuímos cargas aos átomos de uma molécula.
Denomina-se número de oxidação de um elemento a valência do elemento com sinal positivo ou negativo.
Analisando uma molécula de cloreto de hidrogênio, a valência do hidrogênio é 1 e a do cloro também é 1; tendo o cloro eletronegatividade maior que a do hidrogênio, o cloro fica com resíduo negativo e o hidrogênio positivo; portanto, dizemos que o número de oxidação do hidrogênio é +1, e o número de oxidação do cloro é -1.
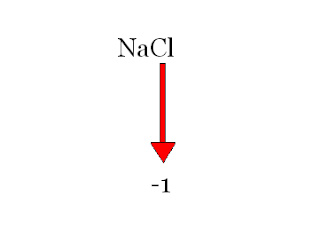
O número de oxidação de um elemento quando forma um íon simples é a própria eletrovalência do íon. Tomando como exemplo o cloreto de sódio (NaCl), o sódio tem eletrovalência +1, e o cloro tem eletrovalência -1.
Regras práticas para a determinação do número de oxidação (NOx)
A soma algébrica dos números de oxidação dos elementos que constituem um composto é igual a zero.
Exemplos:
O número de oxidação (NOx) dos elementos na substâncias simples é igual a zero:
Fe è NOx = 0 H2 è NOx = 0
Al è NOx = 0 O2 è NOx = 0
Em qualquer substância composta, os metais alcalinos (Li, Na, K, Rb, Cs e Fr) têm NOx=+1.
Exemplo:
Em qualquer substância composta, os metais alcalinos terrosos (Be, Mg, Ca, Sr, Ba e Ra) têm NOx= +2.
O hidrogênio tem NOx= +1, com exceção apenas nos hidretos metálicos, nos quais tem NOx= -1.
Exemplos:
O oxigênio tem número de oxidação NOx = -2, com exceção nos peróxidos , em que seu NOx = -1,e nos fluoretos, em que seu NOx = +1 e +2.
Exemplo:
Os halogênios (F, Cl, Br, I e At) têm número de oxidação NOx = -1
Exemplo:
A prata (Ag) em qualquer substância composta tem número de oxidação NOx=+1.
Exemplo:
A soma algébrica dos números de oxidação de todos os átomos constituintes do íon é sempre igual a carga do íon.
Exemplo:
O alumínio (Al) em qualquer substância composta tem número de oxidação NOx=+3
Exemplo:
Aplicações no dia-a-dia
A Eletroquímica é um ramo da química que estuda reações químicas que ocorrem em uma solução envolvendo um condutor (um metal ou um semicondutor) e um condutor iônico (o eletrólito), envolvendo trocas de elétrons entre o eletrodo e o eletrólito.
Este campo científico abrange todos os processos químicos que envolvam transferência de elétrons entre substâncias, logo, a transformação de energia química em energia elétrica. Quando tal processo ocorre, produzindo transferência de elétrons, produzindo espontaneamente corrente elétrica quando ligado a um circuito elétrico, ou produzindo diferença de potencial entre dois polos, é chamado de pilha ou bateria (que muitas vezes é formada de diversas células). Quando tal processo é proporcionado, induzido, pela ação de uma corrente elétrica de uma fonte externa, este processo é denominado de eletrólise.
A Origem da Pilha
A primeira pilha eletroquímica foi criada em 1800, por Alessandro Volta, que utilizou discos (chamados de eletrodos) alternados de cobre e zinco, separadas por algodão embebido em solução salina. O nome "pilha" advém da sobreposição dos diversos discos de metal e algodão.
John Frederic Daniell, em 1836, construiu uma pilha com, eletrodos de cobre e zinco, mas cada eletrodo ficava em uma célula individual, possuindo um tubo, chamado de "ponte salina", que ligava as duas cubas, aumentando sua eficiência. Este tipo de dispositivo passou a ser chamado de pilha de Daniell.
Pilhas e/ou baterias podem ser definidas como geradores químicos de energia elétrica. Tecnicamente, a unidade geradora básica é denominada célula . Em muitos casos práticos, a tensão fornecida por uma célula é insuficiente para operar os equipamentos, de forma que duas ou mais são associadas em série, formando conjuntos. Daí o nome pilha ou bateria. Na linguagem do dia-a-dia, o nome célula é pouco usado e esses termos são aplicados mesmo no caso de uma única célula, como as pilhas comuns de 1,5 volts.
As baterias, ou melhor, células podem ser classificadas em dois grandes grupos:
Não recarregáveis: as reações que geram a energia não podem ser revertidas pela aplicação de uma fonte externa e, portanto, precisam ser trocadas quando esgotadas.
Recarregáveis: as reações são reversíveis pela aplicação de uma fonte externa. Mas não duram para sempre. O número de ciclos de carga-descarga é limitado e depende do tipo. Alguns tipos, como as de automóveis, são também denominadas acumuladores.
Experimento
Tensão Superficial - Experimento
Este experimento visa demonstrar aos alunos uma propriedade inerente a todos os líquidos.
MATERIAIS:
-Uma colher de detergente
-Uma lâmina de barbear
-Um copo com água
-Um conta-gotas
COMO FAZER:
1. Pegue a lâmina de barbear e na posição horizontal coloque dentro do copo com água.
2. Retire a lâmina de barbear com cuidado de dentro do copo com água.
3. Coloque a lâmina de barbear novamente dentro do copo com água mas dessa vez na posição vertical.
4. Retire a lâmina de barbear de dentro do copo com água e repita o PASSO 1
5. Pingue uma gota de detergente na água com o conta-gotas.
MATERIAIS:
-Uma colher de detergente
-Uma lâmina de barbear
-Um copo com água
-Um conta-gotas
COMO FAZER:

1. Pegue a lâmina de barbear e na posição horizontal coloque dentro do copo com água.
2. Retire a lâmina de barbear com cuidado de dentro do copo com água.
3. Coloque a lâmina de barbear novamente dentro do copo com água mas dessa vez na posição vertical.
4. Retire a lâmina de barbear de dentro do copo com água e repita o PASSO 1
5. Pingue uma gota de detergente na água com o conta-gotas.
Gasolina - Experimento
Este experimento tem como objetivos analisar um sistema químico e diferenciá-lo quanto a composição e quanto ao aspecto visual, efetuar extração do álcool da gasolina e promover uma separação de mistura e avaliar de se a gasolina utilizada sofreu adulteração por adição de álcool.
– 5 mL de Gasolina
– 5 mL de Água
– 1 proveta de 10 mL ou uma Seringa de 10mL
– 1 Seringa de 5 mL
COMO FAZER:
1. Usando a seringa coloque 5 mL de gasolina na proveta (ou na seringa de 10mL)
2. A seguir, adicione 5 mL de água, tampe a proveta com a rolha e agite a mistura água-gasolina. 3. Após agitar deixar o sistema em repouso por 1 minuto para que ocorra a separação das fases.
A gasolina é um líquido tóxico e bastante volátil. Durante a realização deste experimento, mantenha o local arejado e evite a inalação dos vapores de gasolina. Por outro lado, a gasolina é altamente inflamável. Assim, durante a realização deste experimento não deve haver qualquer chama acesa no local.MATERIAIS:
– 5 mL de Gasolina
– 5 mL de Água
– 1 proveta de 10 mL ou uma Seringa de 10mL
– 1 Seringa de 5 mL
COMO FAZER:
1. Usando a seringa coloque 5 mL de gasolina na proveta (ou na seringa de 10mL)
2. A seguir, adicione 5 mL de água, tampe a proveta com a rolha e agite a mistura água-gasolina. 3. Após agitar deixar o sistema em repouso por 1 minuto para que ocorra a separação das fases.
Comprimido Efervescente - Experimento
A velocidade das reações químicas depende de muitos fatores. Este experimento visa demonstrar aos alunos a influência da temperatura e da superfície de contato na cinética das reações química (velocidade das reações).
MATERIAIS:
-Um machudador ou pilão
-Água (Natural, Quente e Gelada).
-Quatro comprimidos efervescente
-Quatro copos
COMO FAZER:
1. Pegue o machudor e triture bastante um comprimido efervescente ( com cuidado para não furar o envelope).
2. Encha dois copos com água natural (mesma quantidade de água).
3. Abra o envelope com o comprimido triturado e outro envelope com o comprimido inteiro.
4. Coloque o efervescente em cada um dos copos com água ao mesmo tempo.
5. Nos outros dois copos, coloque água quente e água gelada em cada um deles.
5. Adicione em cada um dos dois copos os outros dois comprimidos efervescentes (ao mesmo tempo).
MATERIAIS:

-Um machudador ou pilão
-Água (Natural, Quente e Gelada).
-Quatro comprimidos efervescente
-Quatro copos
COMO FAZER:
1. Pegue o machudor e triture bastante um comprimido efervescente ( com cuidado para não furar o envelope).
2. Encha dois copos com água natural (mesma quantidade de água).
3. Abra o envelope com o comprimido triturado e outro envelope com o comprimido inteiro.
4. Coloque o efervescente em cada um dos copos com água ao mesmo tempo.
5. Nos outros dois copos, coloque água quente e água gelada em cada um deles.
5. Adicione em cada um dos dois copos os outros dois comprimidos efervescentes (ao mesmo tempo).
Curiosidades :
Texto retirado do livro “estudante nota 10”.da editora DCL (difusão cultural do livro).
Os Experimentos foram retirados do blog:
http://duplat.blogspot.com/2009/03/comprimido-efervescente-experimento.html,
http://duplat.blogspot.com/2009/03/gasolina-experimento.html
http://duplat.blogspot.com/2009/03/tensao-superficial-experimento.html
Curiosidades:
http://ludoquimico.blogspot.com/2009/10/simulacao-entenda-como-funciona-o.html
Aplicações no dia-a-dia:
foram retirados dos sites,http://pt.wikipedia.org/wiki/Eletroqu%C3%ADmica e http://www.mspc.eng.br/tecdiv/bat110.shtml.
Texto digitado e postado por VITOR GABRIEL, ANTONIO VINICIUS do 2° 04








Nenhum comentário:
Postar um comentário